欧米伽3脂肪酸(专业篇)
欧美建议欧米伽3摄入量多少?欧米伽3脂肪酸是什么及如何转换?它有哪些生理活性?欧米伽3可以预防和治疗哪些疾病?欧美如何定义欧米伽3安全性?哪些食物存在欧米伽3?
目录
1.介绍
2.代谢与生物利用度
3.生理活性
- 膜结构和功能
- 视觉
- 神经系统
- 合成脂质介质
- 基因表达调控
- 必需脂肪酸缺乏
- Omega-3缺乏
6.疾病预防
- 妊娠和早期儿童发育
- 心血管疾病
- 糖尿病患者心血管代谢危险因素
- 认知能力下降和阿尔茨海默症
- 年龄相关性黄斑变性
- 癌症预防
- 高甘油三脂血症
- 神经精神障碍
- 非酒精性脂肪肝
- 炎症性疾病
- 食物
- 补充剂
10.安全性
11.相互作用
12.参考文献
介绍
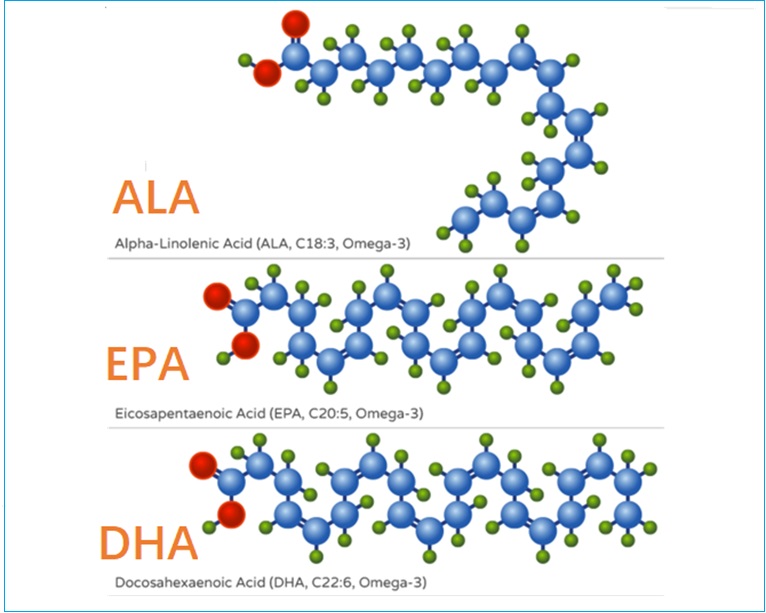
两大类多不饱和脂肪酸(PUFAs)是ω-3和ω-6脂肪酸。与所有脂肪酸一样,PUFAs由长链碳原子组成,链的一端是羧基,另一端是甲基(或ω端)。PUFAs与饱和及单不饱和脂肪酸的区别在于脂肪酸链中碳之间存在两个或多个顺式双键1。在所有ω-6(n-6)脂肪酸中,第一个双键位于脂肪酸甲基末端的第六个和第七个碳原子之间。同样,所有ω-3脂肪酸(n-3)在从脂肪酸甲基端算起的第三和第四个碳原子之间至少有一个双键。脂肪酸的科学缩写表达了一些关于它们化学结构的信息。例如,α-亚麻酸(ALA)的科学缩写是18:3n-3:第一部分(18:3)说明ALA是一种具有三个双键的18碳脂肪酸,而第二部分(n-3)则表明第一个双键位于n-3位置,将这种脂肪酸定义为ω-3(图1A和图1B)。双键在烃链中引入扭结,影响脂肪酸分子的结构和物理性质(图1C)。
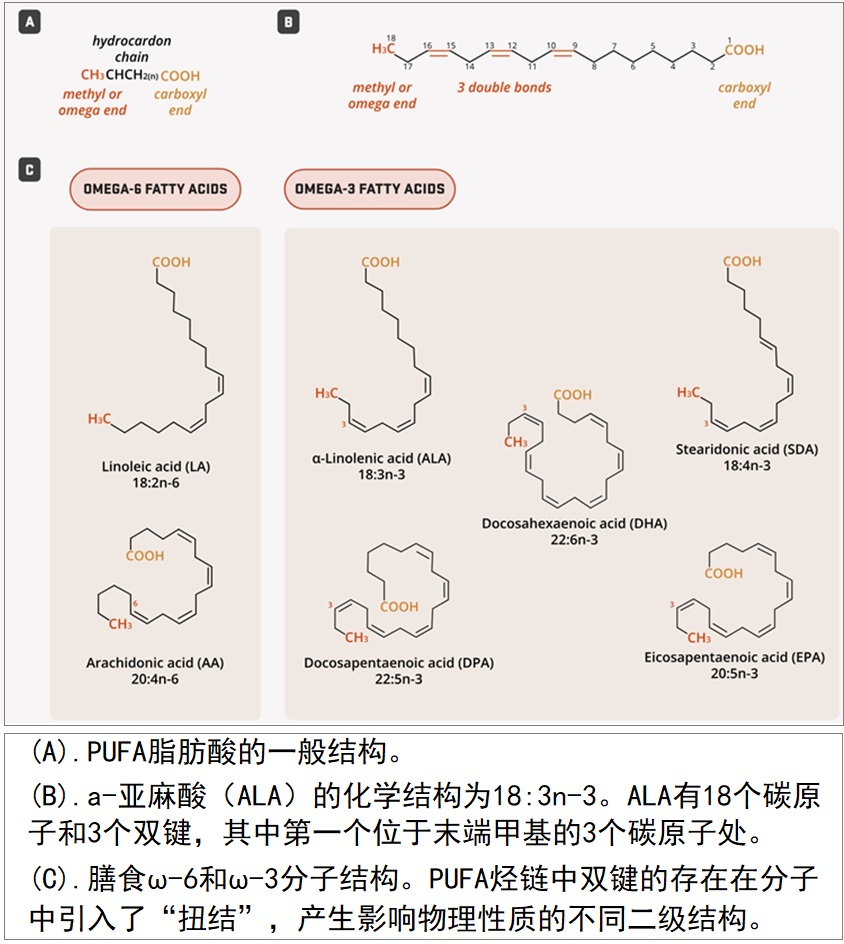
图1. PUFAs化学结构(图源:互联网)
虽然人类和其他哺乳动物可以从碳水化合物和蛋白质中的碳基团合成饱和脂肪酸和一些单不饱和脂肪酸,但它们缺乏在脂肪酸的n-6或n-3位置插入顺式双键所需的δ(Δ)12和Δ15去饱和酶1。因此,Omega-3和Omega-6脂肪酸是人体必需的营养素。Omega-6系列的母体脂肪酸是亚油酸(LA;18:2n-6),Omega-3系列的母体脂肪酸是ALA(图2,18:3n-3)。人类可以从LA合成长链(20个碳或更多)ω-6脂肪酸,如Dh-γ-亚麻酸(DGLA;20:3n-6)和花生四烯酸(AA;20:4n-6),以及从ALA合成长链ω-3脂肪酸,例如二十碳五烯酸(EPA;20:5n-3)和二十二碳六烯酸(DHA;22:6n-3)(见下文“代谢和生物利用度”)。
……。
更多有关欧米伽3循证用途等级、用量和周期,以及产品信息(如品牌、价格对比)等,可参阅本网专文:鱼油既欧米伽3(应用与产品篇) >>
代谢和生物利用度
在小肠吸收之前,脂肪酸必须通过胰腺酶从膳食脂肪(甘油三酯和磷脂)中水解2。胆汁盐也必须存在于小肠中,以便将脂肪酸和其他脂肪消化产物掺入混合胶束中。混合胶束的脂肪吸收发生在整个小肠中,在正常条件下效率为85%-95%。这与其他摄入脂肪的吸收率相似3。在肠细胞内,游离脂肪酸主要结合到乳糜微粒中,并通过淋巴系统进入循环2,3。一旦进入血液,脂蛋白颗粒就会在体内循环,将脂质输送到各个器官,进行随后的氧化、代谢或储存在脂肪组织中2,4。血液中脂肪酸的浓度(即全血、血浆、血清和红细胞)反映了饮食摄入和生物过程5。人类可以分别从必需脂肪酸亚油酸(LA)和α-亚麻酸(ALA)通过一系列去饱和(在两个碳原子之间添加双键)和伸长(添加两个碳分子)反应合成更长的Omega-6和Omega-3脂肪酸(图3)6,7。LA和ALA在合成较长的多不饱和脂肪酸(PUFA)如花生四烯酸(AA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)时竞争相同的长链酶和去饱和酶。
对健康年轻男性ALA代谢的研究表明,约8%的饮食ALA转化为EPA,0%-4%转化为二十二碳六烯酸(DHA)8。在健康的年轻女性中,约21%的膳食ALA转化为EPA,9%转化为DHA9。与男性相比,年轻女性从ALA中产生长链PUFA的能力更强,这与雌激素的作用有关10,11。尽管只有ALA的重要性得到了认可,因为它不能由人类从头合成,但ALA转化为EPA和DHA的相对较低的速率表明,这些长链ω-3脂肪酸可以被视为有条件的必需营养素。
……。
生理活性
1.膜结构和功能Omega-6和Omega-3多不饱和脂肪酸是细胞膜的重要结构成分。当掺入磷脂时,它们会影响细胞膜的特性,如流动性、柔韧性、渗透性以及膜结合酶和细胞信号通路的活性16,17。除了内源性代谢外,膳食摄入脂肪酸还可以改变细胞膜的组成和分子结构。因此,增加Omega-3脂肪酸的摄入量会增加红细胞、免疫细胞18、动脉粥样硬化斑块19、心脏组织20和全身其他细胞类型的ω-3含量。
DHA被选择性地掺入视网膜细胞膜和突触后神经元细胞膜,表明它在视觉和神经系统功能中起着重要作用。事实上,DHA代表了视网膜和神经元细胞中主要的PUFAs21。
2.视觉
DHA在视网膜细胞膜中的浓度非常高;即使ω-3脂肪酸摄入量低,视网膜也会保存和回收DHA22。动物研究表明,DHA是视网膜正常发育和功能所必需的。此外,这些研究表明,在视网膜发育过程中有一个关键时期,DHA不足会导致视网膜功能永久性异常。研究表明,DHA在视觉色素视紫红质的再生中起着重要作用,视紫红质在将照射到视网膜的光转化为大脑中的视觉图像的视觉转导系统中起着至关重要的作用23。
3.神经系统
大脑灰质的磷脂含有高比例的长链PUFAs,表明它们对中枢神经系统功能很重要24。AA刺激皮质星形胶质细胞摄取葡萄糖,这意味着它对能量代谢很重要25。AA和DHA还可以增加乙酰胆碱的释放,从而增强突触可塑性和记忆,从而提高学习能力26。尽管在怀孕和/或婴儿早期补充PUFAs的试验未能显示后代的认知能力得到改善(见下文“疾病预防”),但胎儿和婴儿摄入ω-3和ω-6脂肪酸对其大脑的生长和大脑功能的发展至关重要。有令人信服的证据表明,PUFAs对神经元生长和突触形成以及适当的神经传递至关重要27。
4.脂质介质的合成
4.1.氧合脂类
氧合脂类(Oxylipins)是来自多不饱和脂肪酸的强效化学信使。它们在免疫和炎症反应中起着关键作用。最常见的氧合脂质是类二十烷酸,它包含许多来自20碳(“类二十烷”)AA的生物活性脂质介质。在激素、细胞因子和其他刺激物的刺激下,与膜磷脂结合的PUFA从细胞膜释放出来,成为类十二烷类、类二十烷和类二十二烷物质产生的底物。氧合脂类合成主要依赖于三个酶家族:环氧合酶(COX)、脂氧合酶(LOX)和细胞色素P450单加氧酶(P450s)28。从C18-C22前体开始,COX酶产生前列腺素、前列环素和凝血素(统称为前列腺素类);LOX产生白三烯和羟基脂肪酸;P450产生羟基二十碳四烯酸(“HETEs”)和环氧化物(图4)。
……。
4.2.特异性促炎症消退介质SPMs
最近发现了一类单独的PUFAs衍生的生物活性脂质,即特异性促炎症消退介质(Specialized pro-resolving mediators,SPMs)30。这些分子充当炎症消退阶段的局部介质,积极关闭炎症反应。SPMs来源于ω-6和ω-3多不饱和脂肪酸(图4)31。S系列SPMs是由LOX介导的EPA和DHA的氧化作用产生的,产生S-resolvins、S-protectins和S-maresins。第二类SPMs,即R系列,是由阿司匹林依赖的COX-2乙酰化和随后由AA、EPA和DHA产生的阿司匹林触发的SPMs产生的。这些介质似乎可以解释已知ω-3脂肪酸的许多抗炎作用18,32。
……。
全文总计约29,000多字,引入参考文献约260条。
新会员加入即读全文;已注册会员直接阅读

